8 класс Тема 1-8
В плену у электронов
Мы в плену! В плену у электронов! Они для нас как враги - незнакомы,
непонятны, удивительны. И чтобы этот плен превратился в дружбу и знания,
а значит свободу, мы сегодня будем изучать их поведение, их жизнь внутри
атома.
(слайд №2) Девиз урока:
«Создается впечатление, что природа действительно делает скачки,
и очень необычного свойства».
М. Планк
Цель урока:
• дать понятие об электронной оболочке атома и энергетических уровнях.
Рассмотреть строение электронных оболочек атомов элементов №1 - 20.
• сформулировать представление о завершенном и незавершенном уровнях.
Задача -максимум:
• Создать научное представление об устройстве материального мира.
Задача -минимум:
• актуализировать знания о строении атома;
• научить определять число энергетических уровней в электронной
оболочке атома, число электронов на последнем уровне и степень его завершённости;
• определить физический смысл порядкового номера, номера группы,
номера периода.
Оборудование урока:
Периодическая система элементов Д.И. Менделеева;
Таблица «Строение атома»;
Электронные иллюстрации к уроку;
Компьютер и компьютерный видеопроектор.
Литература для учителя:
О.С. Габриелян и др. Настольная книга учителя, Химия, 8 класс.
М.:Дрофа, 2002.
М.М. Колтун. Мир химии. - М.: Детская литература, 1988.
Р. А. Лидин Химия. Для школьников старших классов и поступаюющих
в вузы. -М.: Дрофа, 2002.
Химия. Мультимедийное учебное пособие нового образца. Просвещение.
ВоскобойниковаН.П., Назарова Н.В. Образование в регионе. №10, 2002.
Литература для школьников:
О.С. Габриелян Химия 8. _ М.: Дрофа, 2002 - 2006.
М.А. Крицман Занимательная химия Ч. 1 - М.: Просвещение 1989.
М.М. Колтун. Мир химии. -М.: Детская литература, 1988.
Н.П. Воскобойникова и др. Дидактические карточки.
Химия. Мультимедийное учебное пособие нового образца. Просвещение
Ход урока
1. Вступительное слово учителя о целях урока.
2. Актуализация знаний о строении атома.
Обсуждение таблицы на стр.7 Дидактических карточек.
Вывод:
- атом состоит из трёх элементарных частиц: протона, нейтрона,
электрона;
- нейтроны и протоны образуют ядро и поэтому их называют нуклонами
(а ядро - нуклид)
- вокруг ядра - электронная оболочка;
- число протонов а значит и заряд ядра равен порядковому номеру;
- так как атом электронейтрален, число электронов равно порядковому
номеру.
3. Изучение нового материала.
Совокупность электронов, окружающих атомное ядро, называется электронной
оболочкой по аналогии с воздушной оболочкой Земли. И подобно последней,
где различают различные слои (атмосферу, тропосферу, ионосферу) в электронной
оболочке различают слои, на которых будут располагаться электроны с различным
запасом энергии, поэтому их называют энергетическими уровнями.
Разные слои располагаются на различном расстоянии от ядра. Электроны,
расположенные на одном энергетическом уровне, имеют приблизительно одинаковый
запас энергии. Электроны, расположенные на разных уровнях, обладают различным
запасом энергии.
Число уровней в атоме определяют по номеру периода:
1 период - 1 энергетический уровень в атомах элементов,
2 период - 2 энергетических уровня в атомах элементов и т.д.
Число электронов, способных располагаться на данном уровне, вычисляется
по формуле:
N (е) = 2n2
1 уровень - максимальное число электронов 2
2 уровень - максимальное число электронов 8
3 уровень - максимальное число электронов 18
Раccмотрим строение электронных оболочек элементов малых периодов
по плану:
1. определить общее число электронов в оболочке (оно равно порядковому
номеру элемента);
2. определить число энергетических уровней (электронных слоев)
в электронной оболочке (по номеру периода)
3. определить число электронов на каждом уровне (на внешнем или
последнем уровне число электронов равно номеру группы).
4. Составление схем строения электронных оболочек атомов.
(слайд №3)
(слайд №4)
(слайд №5)
(слайд №6)
5. Выводы: (слайд №7)
- число энергетических уровней в электронной оболочке равно номеру
периода;
- число электронов на последнем энергетическом уровне равно номеру
группы;
- уровень завершённый, если на нём - 8 электронов.
Я думаю, плен электронов рухнул, мы разгадали почти все их секреты.
Почему почти?... Отвечу словами поэта:
Быть может эти электроны –
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков.
Валерий Брюсов, 1922г.
Ваше поколение получит полную свободу, узнав все секреты элементарных
частиц!
6. Самостоятельная работа в логико-смысловых моделях
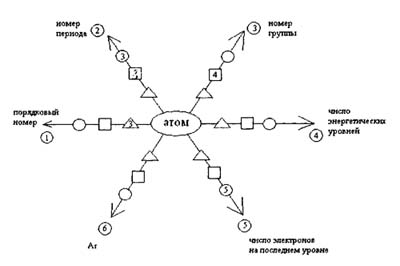
Задания дифференцированы по уровню сложности:
Треугольник - на оценку «3»
Квадрат - на оценку «4»
Круг - на оценку «5».
Обучающийся самостоятельно выбирает уровень сложности и образовательную
траекторию.
7. Задание на дом:
Параграф 8, упр. 1 - 5 . по желанию карточка может быть взята на
дом для выполнения заданий повышенного уровня.
|





